Урок№ 49. химия 8 класс
Тема:«Соли в свете теории электролитической диссоциации»
Цели урока:
-
систематизировать знания учащихся по классу солей. Получить представление о химических свойствах солей в свете теории электролитической диссоциации;
-
продолжить формирование навыков составления формул и названий солей, ионных уравнений реакций;
-
продолжить формирование познавательного интереса к предмету через использование нестандартных форм обучения и создание ситуации успеха;
-
продолжить работу над повышением стремления к самоактуализации;
-
обучать аргументировано защищать свою точку зрения;
-
развитие коммуникабельных способностей;
-
продолжить развитие учебно-интелектуальных, учебно-познавательных, поисково-информационных и учебно-организационных умений.
Оборудование:
Набор текстов, листы учёта знаний, растворы BaCl2, H2SO4, NA2CO3, HCl, NaOH, CuSO4; коллекция минералов: малахит, бирюза, минералы группы апатитов, учебник, тетради.
Ход урока:
-
Оргмомент.
Декларирую четверостишье и обращаюсь к классу с предложением определить тему урока:
Мы часто её за столом встречаем,
Названье её мы сейчас угадаем,
Рассыпать её, говорят, к несчастью,
К обеду иметь, наверное, счастье.
(соль)
Итак, тема урока – «соль». Но у вас уже имеются определённые знания по данной теме. Сегодня мы будем говорить о солях в свете теории электролитической диссоциации.
Далее записываем тему урока.
Определяем цели и задачи урока.
Цель: расширить и углубить наши познания о солях, ведь они так важны для человека.
Сформулировать задачи урока, я надеюсь, поможете мне вы, используя листы учёта знаний по теме. (Приложение 1) Прошу вас выделить в каждом разделе пункты, которые на ваш взгляд соответствуют теме нашего урока. (Этот лист учёта знаний по теме «Электролитическая диссоциация» ученики получают на каждом уроке, на протяжении всего времени изучения данной темы. Лист помогает делать процесс обучения целенаправленным. Он учит учащихся выделять главное при изучении темы, осуществлять целеполагание в системе).
Учащиеся выделяют пункты: I. 1, 4; II. 1, 2, 3; III. 1, 2, 3, 4, 5, 6, 7, 8, 9. Учитель корректирует.
I стадия — Вызов.
Приём «Корзина» идей, понятий, имён…
Прочтём ещё раз тему урока. Что вы уже знаете об этом?
-
Каждый ученик вспоминает и записывает в тетрадь всё, что знает о солях (строго индивидуальная работа, 1-2 мин.).
-
Затем происходит обмен информацией в парах. Ученики делятся друг с другом известными знаниями (групповая работа, 3 мин.).
-
Далее, каждая группа по цепочке называет какое-то одно сведение или факт, при этом, не повторяя ранее сказанного (составляется список идей).
-
Все сведения учитель кратко в виде тезисов записывает в «корзине» идей на доске (без комментариев), даже если они ошибочны. Например, мы получаем следующую корзину:
Твёрдые кристаллические вещества
Ионная кристалическая решётка
электролиты
Реакция обмена
Поваренная соль, мел
Cложные вещества
МеXAy
Соли
Растворимые и нерастворимые
в/д со
щелочами и кислотами
Попытаемся систематизировать имеющиеся знания, заключённые в нашей «корзине».
Приём – «составление кластера».


Химические свойства
Твёрдые
Растворимые в воде



Физические свойства






Получают различными способами
В промышленности
В медицине
В пищевой промышленности




Находят широкое применение



Сложные вещества МеxАy
соли
По мере составления кластера мы видим, что нам не хватает имеющегося опыта и знаний для его завершения. Поэтому настало время познакомиться с новой информацией, т.е. перейти на стадию «осмысление содержания».
II стадия – Осмысление содержания.
Приём – «Зигзаг». Предлагаю учащимся разойтись в экспертные группы ( три группы по количеству текстов) и прочитать выданные тексты (приложения 2, 3, 4), обсудить их, заполнить недостающие звенья в кластере по рассмотренному материалу.
Стадия рефлексии.
Учащиеся возвращаются в первичные рабочие группы, обмениваются информацией, полученной в экспертной группе, заполняют все пропуски в кластере, готовятся к презентации его. Затем учитель вызывает поочерёдно троих учащихся к доске для окончательного заполнения кластера. По мере заполнения раздела классификации солей демонстрируем коллекцию минералов.
Более подробно останавливаемся на химических свойствах солей, проводим опыты, записываем ионные уравнения проделанных реакций.
Заканчивается урок написанием синквейна, в котором выражаем своё отношение к изучаемому материалу:
Соли
Одноосновные, многоосновные
Диссоциируют, взаимодействуют, получаются
Противоречий порождение
Сложные вещества.
Если остаётся время, то можно дать задание составить уравнения реакций нейтрализации гидролиза магния соляной кислотой при соотношении:
1 моль Mg(OH)2 и 2 моль HCl или 1 моль Fe(OH)3 и 3 моль HCl
1 моль Mg(OH)2 и 1 моль HCl 1 моль Fe(OH)3 и 2 моль HCl
1 моль Fe(OH)3 и 1 моль HCl
Домашнее задание:
-
§ 41 (учебник Н.И. Новошинского);
-
№1 на «4» — для второго уровня; №2 на «5» — для третьего уровня.
Инструктивная карта 1
Состав, классификация и номенклатура солей
-
Запомните: соль — это сложное вещество, состоящее из атомов металла и кислотных остатков: СuS04, FеС13, Са(NО3)2. (В приведённых формулах целесообразно выделить металлы и кислотные остатки разными цветами.)
-
Запомните: в зависимости от количественных соотношений кислоты и основания в реакции нейтрализации могут образоваться различные по составу соли (см. схему).
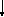
Соли
Двойные
K2NaPO4
KnaCl2
Кислые
KHSO4
NaH2PO4
Основные
MgOHCl
FeOHCl2
Средние
Na3PO4
K2SO4
Средними называют соли, которые образуются при полном замещении атомов водорода в кислоте атомами металлов:
Н5Р04 + ЗNaОН = Na3Р04 + ЗН2О.
ортофосфат
натрия
Кислыми называют соли, которые образуются при неполном замещении атомов водорода в кислоте на атомы металлов:
Н3Р04+2NaОН = Na2НР04 +2Н20.
гидроортофосфат
натрия
Основными называют соли, в которых кроме кислотного остатка присутствуют гидроксогруппы:
Мg(ОН)2 + НС1 = МgОНСl + Н20.
Двойными называют соли, которые образуются при замещении атомов водорода в кислоте атомами двух разных металлов:
Н3Р04 + 2КОН + NаОН = К2NaР04 + ЗН20.
Инструктивная карта 2
Свойства солей
-
Запомните:
а) соли вступают в реакцию с металлами, если металл более активен, чем тот, который
входит в состав соли:
Fе + СuSO4 → FеSO4 + Сu;
б) соли вступают в реакцию с кислотами, если при этом образуется осадок или газ:
ВаС12 + Н2504 →Ва504↓+ НСl;
Ка2С03 + НСl → С02↑+ Н20 + NaСl;
в) соли вступают в реакцию с основаниями, если при этом образуется осадок:
NаОН + СuSO4 → Сu(ОН)21 + Ш2504;
г) соли реагируют с оксидами, если онименее летучи, чем те, которые образуются:
СаС03 + SiO2 → СаSiO3 + С02↑;
д) некоторые соли при нагревании разлагаются:
СаС03 → СаО + С02↑.
-
В схемах химических превращений расставьте коэффициенты.
Инструктивная карта 3
Получение солей
-
Запомните, что соли можно получить при взаимодействии:
а) кислот с основаниями и солями:
NaОН + НСl → NaCl + Н2O;
АgNO3 + НС1 = АgСl↓ + HNO3;
б) щелочей с солями:
Ва(ОН)2 + Na25О4 = ВаS04↓ + NaOH;
в) металлов с кислотами:
Zn + НСl → ZnСl2 + Н2↑;
г) кислотных оксидов со щелочами, основных — с кислотами:
СО2 + Са(ОН)2 → СаСО3 + Н,0;
СаО + НС1 — СаСl2 + Н20;
д) кислотных и основных оксидов:
СаО + СO2 → СаСО3,
е) металлов с неметаллами:
Fе + Сl2 → FеСl3.
2. В схемах химических превращений расставьте коэффициенты.